Daftar isi
Pengertian Elektronegativitas
Elektronegativitas lebih merupakan konsep dan bukan properti, dengan demikian, nilai untuk ini diperkirakan atau dihitung dan bukan diukur. Selama bertahun-tahun, ahli kimia telah menemukan berbagai cara untuk menghitung nilai-nilai untuk elektronegativitas. Elektronegativitas berubah ketika tabel periodik dimajukan dan diturunkan, tidak ada nilai yang diberikan untuk gas inert karena mereka tidak mudah berikatan dengan atom lain.
Elektronegativitas ialah ukuran kecenderungan sebuah ataom untuk menarik elektron yang terikat secara elektrik ketika terikat pada sebuah molekul. Eelektronegativitas berguna untuk semua unsur dari tabel periodik, tetapi lebih bermanfaat untuk non-logam dari kelompok III hingga VII “Clackamas Community College, 2002”.
Ukuran Elektronegativitas
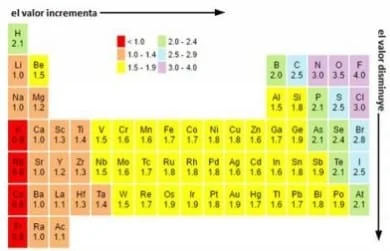
Ukuran yang biasa digunakan dari elektronegativitas unsur-unsur kimia ialah skala elektronegativitas yang diturunkan oleh Linus Pauling pada tahun 1932, didalamnya unsur-unsur tersebut ditabulasi dalam urutan menurun dari keelektronegatifan, fluor menjadi yang paling elektronegatif dan sesium yang paling sedikit.
Skala tersebut berasal dari perbandingan energi yang terkait dengan ikatan kimia antara berbagai kombinasi atom. Skala yang sangat mirip dengan nilai Pauling telah diperoleh dengan pengukuran potensi ionisasi atom dan afinitas elektorn “Encyclopaedia Britannica, 2011”, gambar 1 “lihat pengantar” menunjukkan skala elektronegativitas Pauling “Electronegativity Table og the Elements, S.F.”.
Baca juga: Campuran: Pengertian, Jenis dan Contoh
Ada cara lain untuk mengukur elektronegativitas, seperti skala Mulliken dan skala Allred-Richow, skala elektronegativitas Linus Pauling ialah yang paling umum. Dalam tabel elektronegativitas Pauling, nilai 4 secara bebas ditetapkan untuk fluor dan nilai-nilai lain diperoleh sebagai fungsi fluor. Sesuatu yang mirip dengan berat atom sebagai fungsi karbon 12.
Dapat dilihat bahwa atom-atom menuju kanan atas lebih elektronegatif dan atom-atom yang mengarah ke kiri bawah kurang elektronegatif. Pauling tidak menetapkan elektronegativitas untuk gas mulia karena mereka biasanya tidak membentuk ikatan kovalen.
karena fluor ialah unsur yang paling elektronegatif, elektron cenderung “menempel” lebih ke arah atom fluor ketika fluor secara kovalen terikat dengan atom lain. Oksigen ialah unsur paling elektronegatif kedua “Electronegativity, S.F”.
Ketika memerikasa tabel periodik, akan ditemukan bahwa “tidak termasuk gas mulia” nilai elektronegativitas cenderung meningkat ketika naik dan naik. Pernyataan terbalik ialah nilai cenderung menurun ke bawah dan ke kiri, ini dikenal sebagai sifat periodik “Electronegativity, S.F”.
Tautan Polaritas
Variasi penting dalam ikatan kovalen ialah pada daya tarik yang diberikan pada elektron oleh dua atom yang terhubung satu sama lain. Jika ada ketertarikan yang sama dari kedua atom, maka kita memiliki ikatan nonpolar.
Jika satu atom memberikan tarikan yang lebih kuat pada elektron dari pada yang lain, maka kita memiliki ikatan polar, tentu saja ada tingkat polaritas yang luas. Misalnya ikatan antara dua atom A dan B seperti yang ditunjukkan pada gambar 3. Pasangan elektron diwakili oleh titik-titik berwarna. Setiap atom mungkin membentuk ikatan lain, tetapi ini tidak relevan dengan argumen.
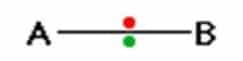
Jika atom sama-sama elektronegatif, keduanya memiliki kecenderungan yang sama, untuk menarik penyatuan pasangan elektron, alasan mengapa mereka akan berada di setengah jalan antara kedua atom. Untuk mendapatkan ikatan seperti A dan B umumnya harus merupakan atom yang sama. Contohnya dapat ditemukan dalam molekul seperti H 2 atau CI 2.
Baca juga: Larutan Elektrolit dan Non Elektrolit
Jenis ikatan ini dapat dianggap sebagai ikatan kovalen “murni”-dimana elektron dibagi secara merata di antara kedua atom. Tetapi apa yang terjadi jika B sedikit lebih elektronegatif dari pada A ?? jawabannya adalah bahwa B akan menarik pasangan elektron dari pada A.
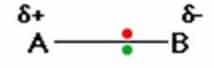
Ini berarti bahwa ujung B dari tautan memiliki lebih dari bagian yang wajar dari kerapatan elektronik dan karenanya menjadi sedikit negatif. Pada saat yang sama, ujung A “agak kekurangan elektron” menjadi sedikit positi. Dalam diagram delta berarti “sedikit”-jari + berarti “sedikit positif”. Ini digambarkan sebagai ikatan plar, ikatan polar adalah ikatan kovalen dimana ada pemisahan muatan antara satu ujung dan lainnya yaitu di mana satu ujung sedikit positif dan yang lainnya sedikit negatif. Contohnya termasuk sebagian besar ikatan kovalen, ikatan hidrogen-klorin dalam HCI atau ikatan hidrogen-oksigen dalam air adalah contoh umumnya “Clark, 2013”.
Peranan Elektronegativitas
Keelektronegatifan suatu unsur membantu kita menentukan seberapa besar kalian ingin mendapatkan atau kehilangan elektron dala suatu reaksi kimia. Ini bagus untuk mengetahui apakah suatu reaksi akan terjadi atau tidak. Kita dapat menentukan bahwa senyawa tersebut ialah ion, polar atau non-polar dengan perbedaan keelektronegatifan.
Jika atom ikatan memiliki elektronegativitas identik, maka itu ialah ikatan kovalen yang sepenuhnya non-polar, ini tidak terjadi di dunia nyata kecuali dua atom dari unsur yang sama. Dalam arti praktis, salah satu dari dua unsur dengan perbedaan keelektronegatifan kurang dari 0,3 dianggap kovalen non-polar. Ketika perbedaan antara atom meningkat, ikatan kovalen menjadi semakin polar.
Pada perbedaan polaritas sekitar 1,7 dianggap bahwa itu tidak lagi ikatan kovalen dan itu ialah karakteristik interaksi elektrostatik dari senyawa ionik. Nilai-nilai ini tidak boleh dianggap seakurat itu, semua interaksi antara atom-atom yang berdekatan menyiratkan distribusi elektron tertentu, tidak peduli seberapa besar perbedaan dalam keelektronegatifan. Tentu saja, kalian tidak akan berharap banyak berbagai elektronik dalam molekul seperti KF, tetapi ada pertukaran elektron kecil pula.





Tinggalkan Balasan