Pengertian Asam Asetat Secara Lengkap – Untuk pembahasan kali ini kami akan memberikan ulasan mengenai Asam Asetat yang dimana dalam hal ini meliputi Pengertian Asam Asetat, Rumus Asam Asetat, Reaksi Asam Asetat dan Fungsi Asam Asetat. Nah agar lebih dapat memahami dan mengerti simak ulasan selengkapnya dibawah ini.
Daftar isi
Pengertian Asam Asetat

Asam asetat adalah senyawa asam organik yang mempunyai rumus CH3COOH dan dapat dibuat dengan fermentasi aerob menggunakan acetobacter. Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting. Sehingga industri pembuatan asam asetat menjadi salah satu industri kimia yang berprospek di Indonesia. Asam asetat di gunakan dalam produksi polimer, berbagai macam serat dain kain, juga dalam industri makanan sebagai pemberi rasa asam dan aroma dalam makanan.
Apa Itu Asam Asetat ?
Asam asetat merupakan salah satu produk industry yang banyak dibutuhkan di Indonesia. Asam asetat dapat dibuat dari berbagai subtrat yang mengandung etanol, yang dapat diperoleh dari berbagai macam bahan seperti buah-buahan, kulit nanas, pulp kopi, dan air kelapa. Hasi dari fermentasi asam asetat sering disebut vinegar yang berarti sour wine. Vinegar berasal dari bahasa Prancis, vindiger (vin=wine, diger=sour). Pada saat ini cuka atau disebut juga vinegar dibuat dari bahan kaya gula seperti buah anggur, apel, nira kelapa, malt, gula sendiri seperti sukrosa dan glukosa, dimana pembuatannya meliatkan proses fermentasi alkohol dan fermentasi asam asetat secara sinambung.
Komposisi Vinegar
Komposisi vinegar tergantung dari bahan baku, proses fermentasi menjadi alkohol dan fermentasi alcohol menjadi asam cuka, pengeraman, serta penyimpanan. Dari Food ad Drugs Administrator (USA), definisi vinegar sebagai berikut: vinegar, cider vinegar, apple vinegar dibuat dari jus apel yang difermentasikan menjadi alcohol dan difermentasikan lebih lanjut menjadi asam cuka. Asam cuka mengandung 4 gram vinegar dalam 100 ml, 200C. wine vinegar, grape vinegar sama denga di atas hanya bahan bakunya dari anggur. Selain itu, ada yang disebut malt vinegar, sugar vinegar, glukosa vinegar.
Baca juga: Campuran Homogen: Pengertian, Sifat Dan Contohnya
Asam Asetat dalam Proses Fermentasi
Dalam proses fermntasi asetat memerlukan pembiakan murni acetobacter yang disebut juga dengan starter. Starter aalah populasi mikroba dalam jumlah dan kondisi fisiologis yang siap diinokulasikan pada media fermentasi. Mikroba pada starter tumbuh dengan cepat dan fermentasi segera terjadi. Media ini diinokulasikan dengan biakan murni. Starter baru dapat digunakan 8 hari setelah diinokulasikan dengan biakan murni. Pemakaian starter tidak diijinkan terlalu banyak karena tidak ekonomis.
Spesifikasi Bahan Baku Asam Asetat
- Methanol
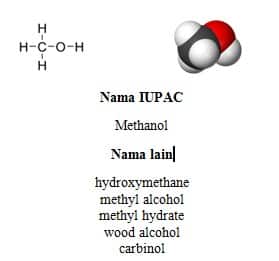
Metanol, juga dikenal sebagai metil alkohol, wood alcohol atau spiritus, adalah senyawa kimia dengan rumus kimia CH3OH. Ia merupakan bentuk alkohol paling sederhana. Pada “keadaan atmosfer” ia berbentuk cairan yang ringan, mudah menguap, tidak berwarna, mudah terbakar, dan beracun dengan bau yang khas (berbau lebih ringan daripada etanol). Metanol digunakan sebagai bahan baku pembuatan asam asetat dengan metode karbonilasi methanol.
Metanol diproduksi secara alami oleh metabolisme anaerobik oleh bakteri. Hasil proses tersebut adalah uap metanol (dalam jumlah kecil) di udara. Setelah beberapa hari, uap metanol tersebut akan teroksidasi oleh oksigen dengan bantuan sinar matahari menjadi karbon dioksida dan air.
- Iodida
Peran iodida adalah hanya untuk mempromosikan konversi methanol menjadi metil iodide:
MaOH + HI MeI + H2O
Setelah metil iodida telah terbentuk maka diteruskan ke reaktor katalis. Siklus katalitik dimulai dengan penambahan oksidatif metil iodida ke dalam [Rh(CO)2I2]– sehingga terbentuk kompleks [MeRh(CO)I3]–
- Rhodium (cis−[Rh(CO)2I2]−)
Rhodium (cis−[Rh(CO)2I2]−) berperan sebagai katalis dalam proses pembuatan asam asetat dalam skala industri. Katalis ini sangat aktif sehingga akan memberikan reaksi dan distribusi produk yang baik.
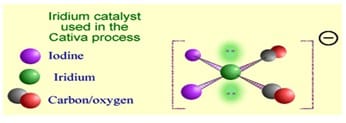
- Iridium ([Ir(CO)2I2]−)
Iridium ([Ir(CO)2I2]−) berperan sebagai katalis dalam proses pembuatan asam asetat dalam skala industri. Penggunaan iridium memungkinkan penggunaan air lebih sedikit dalam campuran reaksi. Struktur katalis kompleks Ir[(CO)2I2]– dapat dilihat seperti gambar berikut:
Spesifikasi Produk Asam Asetat
Asam asetat yang jelas, cairan tak berwarna dengan rumus kimia C2H4O2. Memiliki titik leleh 62,06°F (16.7°C) dan mendidih pada 244,4°F (118°C), kerapatan 1,049g/mL pada 25oC dan flash point 390C. Dalam konsentrasi tinggi,asam asetat bersifat korosif, memiliki bau tajam dan dapat menyebabkan luka bakar pada kulit.
Baca juga: Elektronegativitas: Pengertian, Ukuran dan Peranan
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya adalah asetat (CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar 2.4.
- Struktur Kkristal
Struktur kristal asam asetat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen. Dimer juga dapat dideteksi pada uap bersuhu 120°C. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65.0–66.0 kJ/mol, entropi disosiasi sekitar 154–157 J mol–1 K–1.
- Bersifat Korosif
Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Logam asetat juga dapat diperoleh dengan reaksi asam asetat dengan suatu basa. Contohnya adalah soda kue (Natrium bikarbonat) bereaksi dengan cuka. Hampir semua garam asetat larut dengan baik dalam air. Contoh reaksi pembentukan garam asetat:
Mg(s) + 2 CH3COOH(aq) → (CH3COO)2Mg(aq) + H2(g)
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l)
- Reaksi Asam Karboksilat
Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atau anhidrida asetat melalui substitusi nukleofilik.
Rumus Asam Asetat
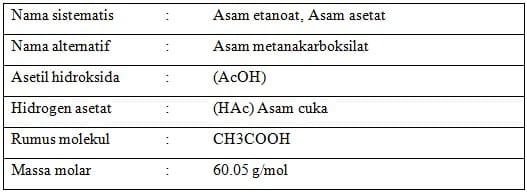
Asam asetat atau asam cuka memiliki rumus C2H4O2, rumus ini pun seringkali ditulis dalam bentuk CH3-COOH, CH3COOH atau CH3CO2H.
Reaksi Kimia Asam Asetat
Asam asetat memiliki sifat korosif terhadap berbagai macam logam seperti besi, serta seng dan magnesium, membentuk gas hidrogen dan garam-garam asetat atau disebut juga logam asetat. Logam asetat juga bisa diperoleh pada reaksi asam asetat dengan suatu basa yang cocok.
Contoh yang sering kita jumpai ialah reaksi soda kue. (Natrium bikarbonat) bereaksi dengan cuka, nyaris semua garam asetat larut secara baik di dalam air.
Asam asetat mengalami reaksi asam karboksilat, contoh mudahnya ialah menghasilkan garam asetat jika bereaksi dengan alkali dan menghasilkan logam etanoat jika bereaksi dengan logam dan menghasilkan logam etanoat.
Asam asetat bisa dikenali dengan baunya dengan ciri yang khas. Selain itu juga garam-garam dari asam asetat bereaksi pada larutan besi klorida dan menghasilkan warna merah yang hilang bila larutan tersebut diasamkan.
Bahaya Asam Asetat
- Jangan menelan. Hindari kulit dan kontak mata. Hindari pajanan terhadap uap atau kabut.
- Potensi Efek Kesehatan:
- Mata: Dapat menyebabkan iritasi.
- Kulit: Dapat menyebabkan iritasi.
- Tertelan: Dapat menyebabkan ketidaknyamanan pencernaan.
- Penghirupan: Dapat menyebabkan iritasi pada saluran pernapasan.
Sifat-Sifat Kimia Asam Asetat
Keasaman
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya adalah asetat (CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka rumah) memilikipH sekitar 2.4 M.

Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen.
Struktur kristal asam asetat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen. Dimer juga dapat dideteksi pada uap bersuhu 120 °C. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni. Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65.0–66.0 kJ/mol, entropi disosiasi sekitar 154–157 J mol–1 K–1. Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya.
Sebagai Pelarut
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6.2, sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur- unsur seperti sulfur dan iodin. Asam asetat bercambur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia.
Baca juga: Proses Pengolahan Minyak Bumi
Reaksi-reaksi kimia
Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Logam asetat juga dapat diperoleh dengan reaksi asam asetat dengan suatu basa yang cocok. Contoh yang terkenal adalah reaksi soda kue (Natrium bikarbonat) bereaksi dengan cuka. Hapir semua garam asetat larut dengan baik dalam air. Salah satu pengecualian adalah kromium (II) asetat. Contoh reaksi pembentukan garam asetat:
Mg(s) + 2 CH3COOH(aq) → (CH3COO)2Mg(aq) + H2(g)
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l)
Aluminium merupakan logam yang tahan terhadap korosi karena dapat membentuk lapisan aluminium oksida yang melindungi permukaannya. Karena itu, biasanya asam asetat diangkut dengan tangki-tangki aluminium.
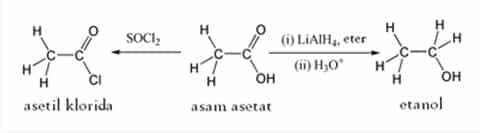
Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi denganalkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat.
Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atauanhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat.Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 °C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air.
Deteksi
Asam asetat dapat dikenali dengan baunya yang khas. Selain itu, garam-garam dari asam asetat bereaksi dengan larutan besi(III) klorida, yang menghasilkan warna merah pekat yang hilang bila larutan diasamkan. Garam-garam asetat bila dipanaskan dengan arsenik trioksida (AsO3) membentuk kakodil oksida ((CH3)2As-O-As(CH3)2), yang mudah dikenali dengan baunya yang tidak menyenangkan.
Penggunaan Asam Asetat
Kegunaan Asam Asetat secara umum
Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl acetate monomer, VAM). Selain itu asam asetat juga digunakan dalam produksi anhidrida asetat dan juga ester. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil.
Kegunaan Asam Asetat secara Detail
Adapun penggunaan asam asetat yang diantaranya yaitu:
- Sebagai Pereaksi Kimia, Pereaksi kimia dilakukan untuk menghasilkan berbagai macam senyawa kimia. Asam asetat juga biasanya digunakan untuk produksi monumel vinil. Selain itu digunakan juga untuk pereaksin kimia yang lainnya.
- Produksi Polimer, Petan asam asetat dalam produksi polimer ini sangat membantu, sebab itu perlu digunakannya asam asetat ini. Selain itu asam asetat juga memang memiliki berbagai macam fungsi.
- Sebagai Pengatur Keasaman, Biasanya asam asetat digunakan sebagai pengatur keasaman pada industri makanan.
- Sebagai Pelunak Air, Jika dalam industri makanan kebanyakan asam asetat digunakan untuk mengatur keasaman, beda dengan dirumah tangga biasanya asam asetat digunakan sebagai pelunak air.
- Minuman Fungsional, Nah ini yang jarang kita dengar, ternyata asam asetat digunakan untuk minuman fungsional, contohnya cuka apel dan minuman fungsional lainnya.
- Bahan Baku Membuat Bahan Kimia, Sering juga digunakan untuk membuat bahan baku kimia, namun harus disesuaikan dengan kebutuhannya.
- Digunakan kedalam produksi ester.
- Produksi anhidrida asetat.





Tinggalkan Balasan