Tabel Periodik – Untuk pembahasan kali ini kami akan mengulas mengenai Sistem Periodik Unsur yang dimana dalam hal ini meliputi pengertian, perkembangan, konfigurasi, periode, golongan, sifat, gambar dan contoh, nah agar dapat lebih memahami dan dimengerti simak ulasan selengkapnya dibawah ini.
Daftar isi
Pengertian Tabel Sistem Periodik Unsur
Sistem periodik unsur adalah sebuah tabel yang memuat seluruh unsur kimia yang dikenal oleh IUPAC (International Union of Pure and Applied Chemistry). Di dalam tabel periodik,unsur-unsur kimia dikelompokan berdasarkan kesamaan sifatnya. Dengan memanfaatkan tabel periodik,kita dapat membuat klasifikasi, penafsiran, dan perkiraaan yang sistematik dari semua informasi kimia. Selain itu,kita juga dapat lebih mudah mempelajari struktur atom.
Perkembangan Sistem Periodik Unsur
Sejarah perkembangan Sistem Periodik Unsur dan penyusunan Sistem Periodik Unsur telah mengalami banyak penyempurnaan mulai dari:
Lavoiser

Dalam sistem ini pengklasifikasikan unsur di dasarkan pada kemampuan unsur itu untuk menghantarkan listrik dan panas. Menurut sistem ini unsur di kelompokkan menjadi dua jenis yaitu:
- Unsur logam ( unsur yang dapat menghantarkan listrik dan panas), misalnya besi, tembaga, perak, emas, dan sebagainya.
- Unsur non logam ( unsur yang tak dapat menghantarkan arus listik dan panas), misalnya belerang, oksigen, klor, nitrogen, arsen, fosfor, hydrogen, dan karbon.
Dari semua unsur yang sudah di temukan pada masa itu. Sebagin besar unsur kurang lebih 70% adalah logam sehingga para ahli mengelompokkan unsur menjadi dua bagian yaitu logam dan nonlogam antara lain sebagai berikut :
a) Logam
Sifat logam, terdiri atas:
- Dapat menghantarkan panas dan listrik (kerapatan tinggi )
- Mudah di bentuk atau padat (dapat di tempat dan diregangkan seperti kawat).
- Mengkilap terlebih jika digosok.
- Keelektron positif. Pada umumnya berwujud padat pada suhu kamar.
- Bersifat reduktor atau basa ( mengalami oksidasi = melepaskan electron)
b) Nonlogam
Sifat non logam, terdiri atas:
- Tidak dapat menghantarkan panas dan listrik (kerapatan rendah )
- Yang berwujud padat umumnya rapuh (sukar di bentuk).
- Tidak mengkilap atau buram
- Ada yang berwujud padat, cair, atau gas.
- Bersifat oksidator atau asam (Mengalami reduksi = menyerap elektron).
Baca juga: Pengertian Asam, Basa dan Garam
Dalton
Dalton mengemukakan bahwa unsur dari atom yang berbeda mempunyai sifat dan massa yang berbeda. Massa atom diperoleh dari perbandingan massa atom unsur terhadap massa atom unsur hidrogen. Berangkat dari teorinya itu Dalton mengelompokkan zat-zat yang berupa unsur-unsur (sebanyak 36 unsur) berdasarkan kenaikan massa atomnya.
Daftar Unsur yang disusun oleh Dalton:

John Jacobs Berzelius (1828)
Dalam daftar massa unsur yang dibuat oleh Dalton terdapat kesalahan dalam penentuan massa atom unsur. Pada tahun 1828 Barzellius berhasil membuat dan mempublikasikan daftar massa atom unsur-unsur yang lebih akurat. Lambang unsur ditemukan oleh John Jacob Berzelius. Aturan yang digunakan yaitu, simbol kimia yang digunakan adalah singkatan dari nama latin karena waktu itu bahasa latin merupakan bahasa sains, misalnya Fe adalah simbol untuk unsur ferrum (besi), Hg adalah simbol untuk hydrargyrum (raksa), dll. Secara internasional, huruf pertama simbol kimia ditulis dalam huruf capital, sedangkan huruf selanjutnya jika ada ditulis dalam huruf kecil. Sistem periodik unsur dapat membantu mempelajari jumlah unsur yang semakin banyak dan membuatnya lebih praktis.
Johan W. Dobereiner (1817)
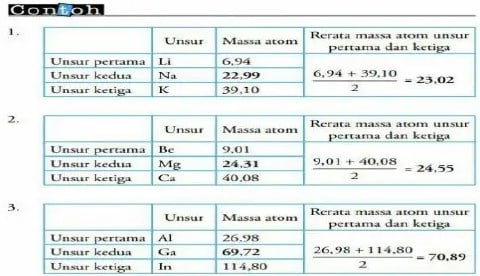
Pada tahun 1829, J.W. Dobereiner seorang profesor kimia dari Jerman mengelompokan unsur-unsur berdasarkan kemiripan sifat-sifatnya.Ia mengemukakan bahwa massa atom relatif strontium sangat dekat dengan masa rata-rata dari dua unsur lain yang mirip dengan strantium, yaitu kalsium dan barium dan juga mengemukakan beberapa kelompok unsur lain. Dobereiner meyimpulkan bahwa unsur-unsur dapat dikelompokan ke dalam kelompok-kelompok tiga unsur yang di sebut triade.
Kelemahan dari teori ini adalah pengelompokan unsur ini kurang efisien dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur dalam kelompok triade tersebut. Kelebihan dari teori ini adalah adanya keteraturan setiap unsur yang sifatnya mirip massa Atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga.
A. R. Newland (1863-1865)
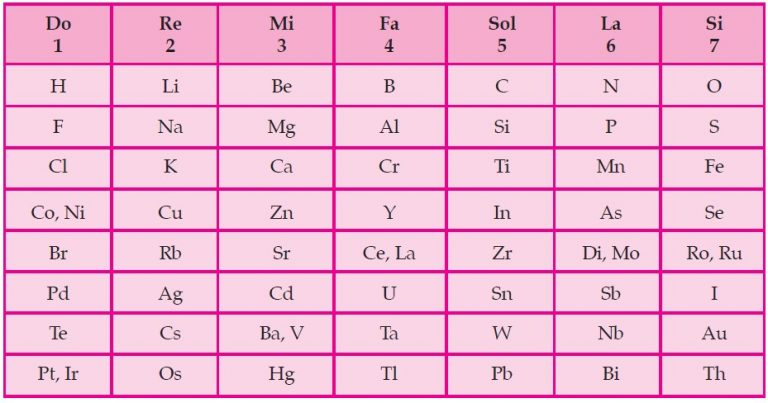
Newlands merupakan orang pertama yang mengelompokan unsur-unsur berdasarkan kenaikan massa atom relatif. Newlands mengumumkan penemuanya yang disebut hukum oktaf.
Ia menyatakan bahwa sifat-sifat unsur berubah secara teratur. Unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan, dan seterusnya. Daftar unsur yang disusun oleh Newlands berdasarkan hukum oktaf. Disebut Hukum Oktaf karena beliau mendapati bahwa sifat-sifat yang sama berulang pada setiap unsur ke delapan dalam susunan selanjutnya dan pola ini menyerupai oktaf musik.
Hukum oktaf newlands ternyata hanya berlaku untuk unsur-unsur ringan. Jika diteruskan, teryata kemiripan sifat terlalu dipaksakan. Misalnya, Ti mempunya sifat yang cukup berbeda dengan Al maupun B.
Kelemahan dari teori ini adalah dalam kenyataanya masih diketemukan beberapa oktaf yang isinya lebih dari delapan unsur. Dan penggolonganya ini tidak cocok untuk unsur yang massa atomnya sangat besar.
Lothar Meyer
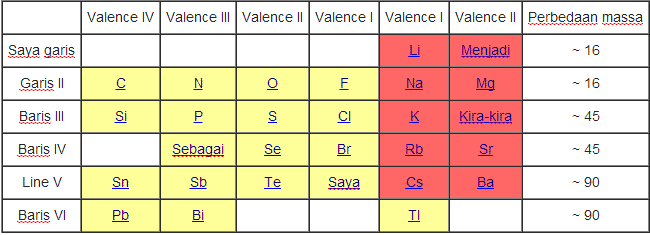
Pada tahun 1969, Lothar Meyer mengamati hubungan antara kenaikan massa atom dengan sifat unsur. Hal ini dilakukan antara lain dengan membuat Kurva volume atom versus fungsi massa atom.
Dari kurva, ia mengamati adanya keteraturan dari unsur-unsur dengan sifat yang mirip, dan pengulangan sifat unsur tidak selalu setelah 8 unsur, seperti dinyatakan dalam hukum oktaf.
Unsur-unsur disusun berdasarkan kenaikan massa atom secara vertikal. Pengulangan sifat unsur membentuk kolom. Sedangkan unsur-unsur dengan sifat yang mirip terletak pada baris yang sama.
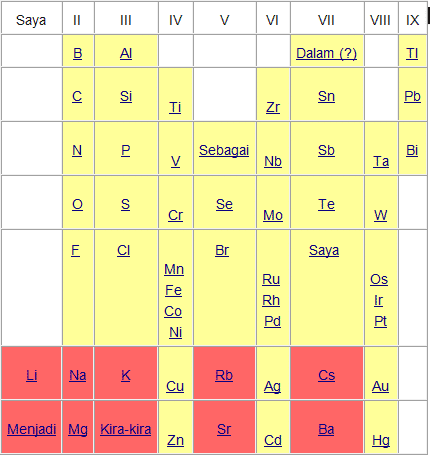
Dmitri Mendeleev
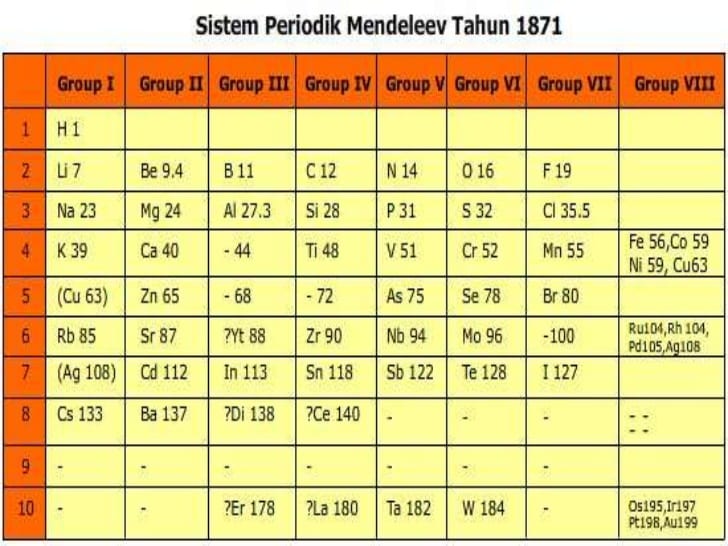
Pada tahun 1869 seorang sarjana asal rusia bernama Dimitri Ivanovich Mendeleev, berdasarkan pengamatan terhadap 63 unsur yang sudah dikenal ketika itu, menyimpulkan bahwa sifat-sifat unsur adalah fungsi periodik dari massa atom relatifnya. Tabel Sistem Periodik Mendeleev yang telah disempurnakan (1871) terdiri atas golongan (lajur tegak) dan periode (deret mendatar).
Keuntungan Tabel Periodik Mendeleev dalam memahami sifat unsur ialah:
- Sifat kimia dan sifat fisika unsur dalam satu golongan berubah secara teratur.
- Dapat meramal sifat unsur yang belum diketemukan, yang akan mengisi tempat kosong dalam daftar.
- Tabel ini tidak mengalami perubahan setelah penemuan unsur-unsur gas mulia.
Kelemahan Tabel Periodik Mendeleyev:
- Panjang periode tidak sama.
- Triade besi (Fe, Co, dan Ni), triade platina ringan (Ru, Rh, dan Pd), dan triade platina (Os,Ir, dan Pt) dimasukkan ke dalam golongan VIII.
- Selisih massa atom relatifnya antara dua unsur yang berurutan tidak teratur (antara –1 dan +4), sehingga sukar untuk meramal unsur-unsur yang belum ditemukan.
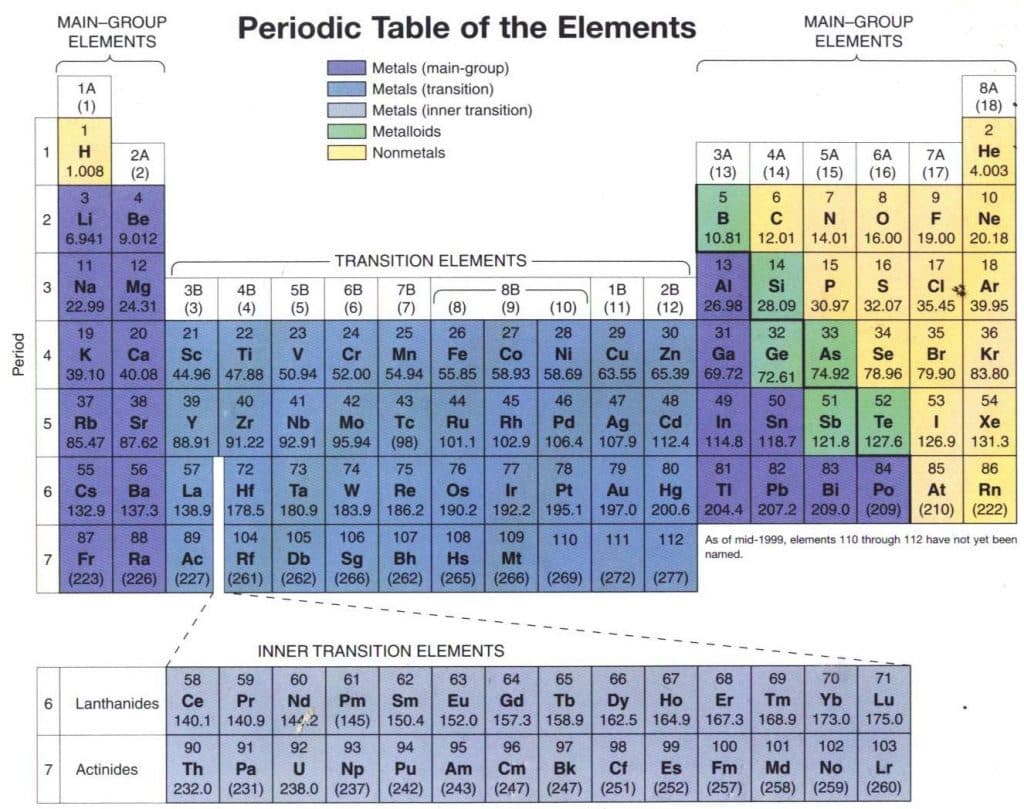
Sebagaimana dapat dilihat pada gambar di atas, Mendeleev mengkosongkan beberapa tempat. Hal itu dilakukan untuk menetapkan kemiripan sifat dalam golongan. Sebagai contoh, Mendelev menempatkan Ti (Ar = 48) pada golongan IV dan membiarkan golongan III kosong karena Ti lebih mirip dengan C dan Si, dari pada dengan B dan Al. Mendeleev meramalkan dari sifat unsur yang belum di kenal itu.
Perkiraan tersebut didasarkan pada sifat unsur lain yang sudah dikenal, yang letaknya berdampingan baik secara mendatar maupun secara tegak. Ketika unsur yang diramalkan itu ditemukan, ternyata sifatnya sangat sesuai dengan ramalan mendeleev. Salah satu contoh adalah germanium (Ge) yang ditemukan pada tahun 1886, yang oleh Mendeleev dinamai ekasilikon.
Baca juga: Pengertian Asam Asetat Secara Lengkap
Henry G. Moseley
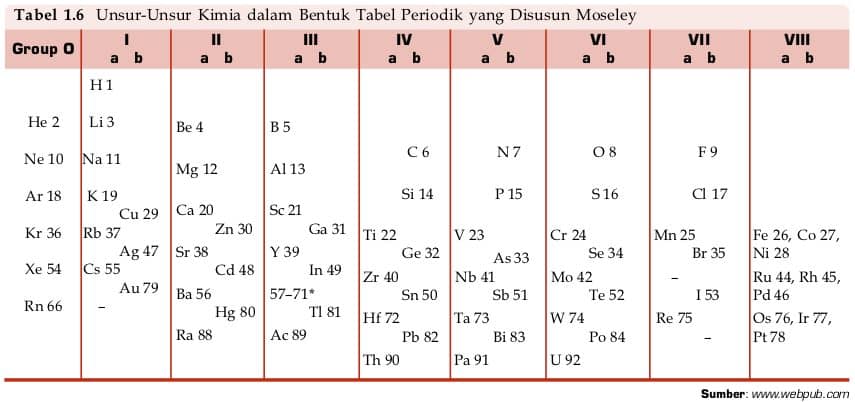
Pada awal abad 20, pengetahuan kita terhadap atom mengalami perkembangan yang sangat mendasar. Para ahli menemukan bahwa atom bukanlah suatu partikel yang tak terbagi melainkan terdiri dari partikel yang lebih kecil yang disebut partikel dasar atau partikel subatom. Kini atom di yakini terdiri atas tiga jenis partikel dasar yaitu proton, elektron, dan neuron.
Jumlah proton merupakan sifat khas dari unsur, artinya setiap unsur mempunyai jumlah proton tertentu yang berbeda dari unsur lainya. Jumlah proton dalam satu atom ini disebut nomor atom. pada 1913, seorang kimiawan inggris bernama Henry Moseley melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X.
Berdasarkan hasil eksperimenya tersebut, diperoleh kesimpulan bahwa sifat dasar atom bukan didasari oleh massa atom relatif, melainkan berdasarkan kenaikan jumlah proton. Ha tersebut diakibatkan adanya unsur-unsur yang memiliki massa atom berbeda, tetapi memiliki jumlah proton sama atau disebut isotop.
Kenaikan jumlah proton ini mencerminkan kenaikan nomor atom unsur tersebut. Pengelompokan unsur-unsur sistem periodik modern merupakan penyempurnaan hukum periodik Mendeleev, yang disebut juga sistem periodik bentuk panjang.
Tabel Periodik Modern
Pada tahun 1913, seorang ahli fisika muda berkebangsaan Ingris henry Moseley (Henry Gwyn-Jeffreys Moseley, 1887-1915) menemukan hubungan antara nomor atom dengan frekuensi sinar-X yang dihasilkan dari penembakan unsur tersebut dengan elektron berenergi tinggi, dengan beberapa pengecualian, moseley menemukan bahwa nomor atom meningkat seiring dengan meningkatnya massa atom. Berdasarkan kenyataan ini Moseley memodifikasi sistem periodik Mendeleev dan menghasilkan Sistem Periodik Modernyang kita kenal sekarang ini.
Penyusunan sistem periodik unsur berdasarkan nomor atom dan sifat atom dilakukan berdasarkan kenyataan bahwa unsur-unsur yang sama berarti memiliki sifat-sifat yang sama,dapat memiliki massa atom yang berbeda atau isotop. Dengan demikian sifat-sifat kimia suatu unsur tidak ditentukan oleh massa atomnya, melainkan di tentukan oleh jumlah proton dalam atom tersebut. Jika jumlah proton merupakan nomor atom unsur, unsur-unsur di susun berdasarkan kenaikan nomor atom bukan berdasarkan nomor massanya.
Konfigurasi Elektron
Konfigurasi elektron adalah pengisian atau penyebaran elektron-elektron pada kulit-kulit atom. Pengisian elektron pada kulit-kulit atom mempunyai aturan-aturan tertentu sebagai berikut :
- Jumlah maksimum elektro pada suatu kulit memenuhi 2 n
- Jumlah maksimum pada kulit terluar adalah 8. Hal ini disebabkan pada system periodik hanya ada 8 golongan
- Pada keadaan normal, pengisian electron dimulai dari kulit bagian dalam (kulit K) untuk unsure nomor atom 1 sampai 18, kulit bagian luar diisi setelah kulit bagian dalam terisi penuh.
Table Pengisian Atom dalam Elektron
| Atom | Jumlah electron | Kulit k | Kulit L | Kulit M | Kulit N |
| 1H | 1 | 1 | |||
| 3Li | 3 | 2 | 1 | ||
| 7N | 7 | 2 | 5 | ||
| 13Al | 13 | 2 | 8 | 3 | |
| 35Br | 35 | 2 | 8 | 18 | 7 |
Pada kilit berikutnya ternyata jumlah elektron tidak cukup, tetapi lebih besar dari kulit sebelumnya maka di isi sama dengan kulit sebelumnya. Kemudian pada kulit terluar di isi dengan elektron sisanya.
Periode dan Golongan
Terdiri atas:
Periode
Periode ditempatkan pada lajur horizontal dalam sistem periodik modern. Periode suatu unsur menunjukan suatu nomor kulit yang sudah terisi elektron (n terbesar) berdasarkan konfigurasi elektron. Konfigurasi elektron adalah persebaran elektron dalam kulit-kulit atomnya.
Dalam sistem periodik modern terdapat 7 periode, yaitu :
- periode 1 (periode sangat pendek) berisi 2 unsur, yaitu H dan He.
- periode 2 (periode pendek) berisi 8 unsur yaitu, Li, Be, B, C, N, O, F, Ne.
- periode 3 (periode pendek) berisi 8 unsur, yaitu Na, Mg, Al, Si, P, S, Cl, Ar.
- periode 4 (periode panjang) berisi 18 unsur, yaitu K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr.
- periode 5 (periode panjang) berisi 18 unsur, yaitu Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd, In, Sn, Sb, Te, I, Xe.
- periode 6 (periode sangat panjang)berisi 32 unsur yaitu, 18 unsur seperti pada periode 4 atau ke-5, yaitu Cs, Ba, La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At, Rn, dan 14 unsur lagi merupakan deret lantanida, yaitu Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
- periode 7 (periode sangat panjang) berisi 28 unsur, yaitu Fr, Ra, Ac, Rf, Db, Sg, Bh, Hs,Mt, Uun, Uuu, Uub, Uut, Uuq, Uup, Uuh, Uus Uuobelum lengkap karena maksimum 32 unsur. Pada periode ini terdapat deret aktinida yaitu Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Golongan
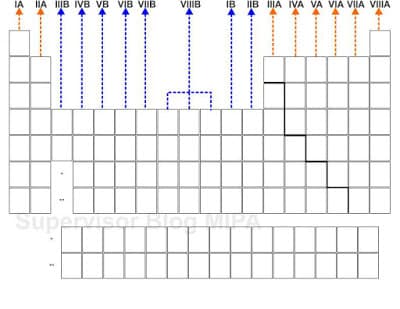
Golongan adalah lajur tegak pada tabel periodik unsur. Unsur-unsur yang ada dalam satu lajur tegak adalah unsur-unsur segolongan, terdapat delapan golongan utama dan delapan golongan transisi.
Golongan Utama

Golongan utama tersebut adalah :
- Golongan I A disebut golongan alkali (kecuali H) terdiri dari unsur-unsur : H, Li, Na, K, Rb, Cs, Fr .
- Golongan II A disebut golongan alkali tanah yang terdiri dari unsur-unsur : Be, Mg, Ca, Sr, Ba, Ra.
- Golongan III A disebut golongan baron aluminium yang terdiri dari unsur-unsur: B, Al, Ga, In, Ti, Uut.
- Golongan IV A disebut golongan karbon-silicon yang terdiri dari unsur-unsur : C, Si, Ge Sn, Pb, Uuq.
- Golongan V A disebut golongan nitrogen-fosforus yang terdiri dari unsur-unsur: N, P, As, Sb, Bi, Uup.
- Golongan VI A disebut golongan oksigen-belerang yang terdiri dari unsur-unsur: O, S, Se, Te, Po, Uuh.
- Golongan VII A disebut golongan halogen yang terdiri dari unsur-unsur : F, Cl, Br, I, At.
- Golongan VIII A disebut golongan gas mulia yang terdiri dari unsur-unsur : He, Ne, Ar, Kr, Xe, Rn.
Golongan transisi
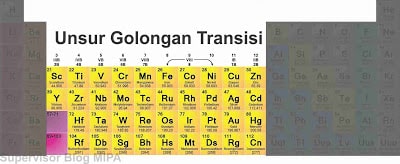
Golongan transisi tersebut adalah :
- Golongan I B terdiri dari unsur-unsur Cu, Ag, Au, Rg.
- Golongan II B terdiri dari unsur-unsur Zn, Cd, Hg, Uub.
- Golongan III B terdiri dari unsur-unsur Se,Y, La, Ac.
- Golongan IV B terdiri dari unsur-unsur Ti, Zr, Hf, Rf.
- Golongan V B terdiri dari unsur-unsur V, Nb, Ta, Db.
- Golongan VI B terdiri dari unsur-unsur Cr, Mo, W, Sg.
- Golongan VI B terdiri dari unsur-unsurMn, Te, Re,Bh.
- Golongan VIII B terdiri dari unsur-unsur Fe, Ru, Os, Hs, Co, Rh, Ir, Mt, Ni, Pd, Pt, Ds.
Pada periode 6 dan 7 terdapat masing-masing 14 unsur yang disebut unsur-unsur transisi dalam, yaitu unsur-unsur antanida dan aktinida. Unsur-unsur transisi dalam semua termasuk golongan IIIB. Unsur-unsur lantanida pada periode 6 golongan IIIB, dan unsur-unsur aktinida pada periode 7 golongan IIIB. Penempatan unsur-unsur tersebut di bagian bawah tabel periodik adalah untuk alasan teknis, sehingga daftr tidak terlalu panjang.
Sifat-Sifat Periodik Unsur
Berikut ini terdapat beberapa sifat-sifat periodik unsur, terdiri atas:
Jari-Jari Atom
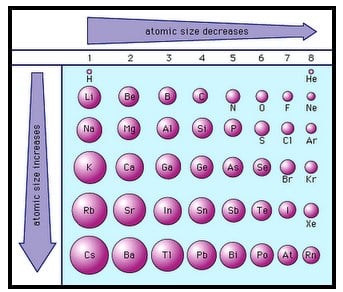
Jari-jari atom adalah jarak dari inti atom ke kulit terluar. Besarnya jari-jari atom dipengaruhi oleh jumlah kulit elektron dan muatan inti atom.
Dalam suatu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas, kulit elektron semakin kecil.
Dalam suatu periode, semakin ke kanan jari-jari atom cenderung semakin kecil. Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin banyak, sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga tarikan inti terhadap elektron terluar semakin kuat.
Jari-Jari Ion
Ion mempunyai jari-jari yang berbeda secara nyata (signifikan) jika dibandingkan dengan jari-jari atom netralnya. Ion bermuatan positif (kation) mempunyai jari-jari yang lebih kecil, sedangkan ion bermuatan negatif (anion) mempunyai jari-jari yang lebih besar jika dibandingkan dengan jari-jari atom netralnya.
Energi Ionisasi
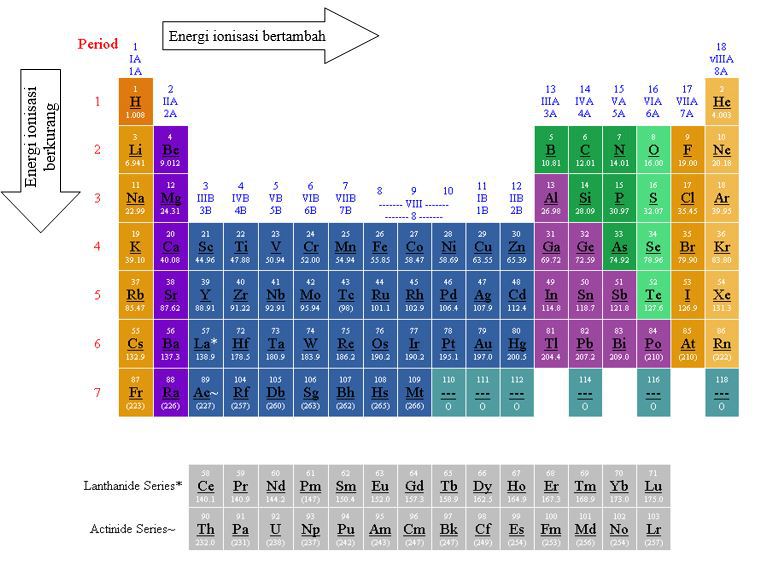
Energi ionisasi adalah besarnya energi yang diperlukan oleh suatu atom/ion untuk melepaskan sebuah elektron yang terikat paling lemah (elektron teluar).
Energi ionisasi merupakan energi yang digunakan untuk melawan gaya tarik inti terhadap elektron terluarnya, jadi semakin jauh dari inti maka semakin kecil energi ionisasinya dan semakin mudah elektron itu dilepaskan.
Baca juga: Campuran Homogen: Pengertian, Sifat Dan Contohnya
Dalam suatu periode semakin banyak elektron dan proton gaya tarik menarik elektron terluar dengan inti semakin besar (jari-jari kecil). Akibatnya, elektron sukar lepas sehingga energi untuk melepas elektron semakin besar. Hal ini berarti energi ionisasi besar. Jika jumlah elektronnya sedikit, gaya tarik menarik elektron dengan inti lebih kecil (jari-jarinya semakain besar). Akibatnya, energi untuk melepaskan elektron terluar relatif lebih kecil berarti energi ionisasi kecil.
- Unsur-unsur yang segolongan : energi ionisasi makin ke bawah makin kecil, karena elektron terluar makin jauh dari inti (gaya tarik inti makin lemah), sehingga elektron terluar makin mudah di lepaskan.
- Unsur-unsur yan seperiode : energi ionisai pada umumnya makin ke kanan makin besar, karena makin ke kanan gaya tarik inti makin kuat.
Kekecualian :
Unsur-unsur golongan II A memiliki energi ionisasi yang lebih besar dari pada golongan III A, dan energi ionisasi golongan V A lebih besar dari pada golongan VI A.
Afinitas Elektron
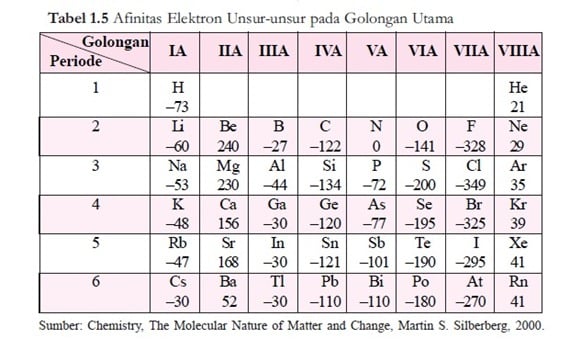
Afinitas Elektron adalah besarnya energi yang dibebaskan oleh suatu atom untuk menerina sebuah elektron.
Jadi, besaran afinitas elektron merupakan besaran yang dapat digunakan untuk mudah tidaknya atom untuk menarik elektron. Semakin besar afinitas elektron yang dimiliki atom itu menunjukan bahwa atom itu mudah nenarik elektron dari luar dan membentuk ion negatif(anion). Jika ion negatif yang terbentuk bersifat stabil, maka proses penyerapan elektron itu disertai pelepasan energi dan afinitas elektronnya dinyatakan dengan tanda negatif.
Akan tetapi jika ion negatif yang terbentuk tidak stabil, maka proses penyerapan elektron akan membutuhkan energi dan afinitas elektronnya dinyatakan dengan tanda positif. Jadi, unsur yang mempunyai afinitas elektron bertanda negatif mempunyai kecenderungan lebih besar menyerap elektron daripada unsur yang afinitas elektronnya bertanda positif. Makin negatif nilai afinitas elektron berarti makin besar kecenderungan menyerap elektron.
Dalam satu periode dari kiri ke kanan, jari-jari semakin kecil dan gaya tarik inti terhadap elektron semakin besar, maka atom semakin mudah menarik elektron dari luar sehingga afinitas elektron semakin besar.
Pada satu golongan dari atas ke bawah, jari-jari atom makin besar, sehingga gaya tarik inti terhadap elektron makin kecil, maka atom semakin sulit menarik elektron dari luar, sehingga afinitas elektron semakin kecil.
Dalam satu periode, dari kiri ke kanan afinitas elektron bertambah. Dalam satu golongan, dari atas ke bawah afinitas elektron berkurang.
Keelektronegatifan
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari atom lain. Faktor yang mempengaruhi keelektronegatifan adalah gaya tarik dari inti terhadap elektron dan jari-jari atom. Harga keelektronegatifan bersifat relatif (berupa perbandingan suatu atom yag lain).
- Unsur-unsur yang segolongan : keelektronegatifan makin ke bawah makin kecil, karena gaya taik-menarik inti makin lemah. Unsur-unsur bagian bawah dalam sistem periodik cenderung melepaskan elektron.
- Unsur-unsur yang seperiode : keelektronegatifan makin ke kanan makin besar. Keelektronegatifan terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur halogen). Harga keelektronegatifan terbesar terdapat pada flour (F) yakni 4,0, dan harga terkecil terdapat pada fransium (Fr) yakni 0,7.
Harga keelektronegatifan penting untuk menentukan bilangan oksidasi (biloks) unsur dalam sutu senyawa. Jika harga keelektronegatifan besar, berarti unsur yang bersangkutan cenderung menerim elektron dan membentuk bilangan oksidasi negatif. Jika harga keelektronegatifan kecil, unsur cenderung melepaskan elektron dan membentuk bilangan oksidasi positif. Jumlah atom yang diikat bergantung pada elektron valensinya.
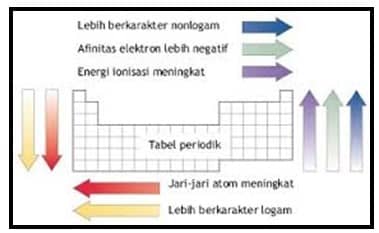
Sifat Logam dan Non Logam
Sifat-sifat unsur logam yang spesifik, antara lain : mengkilap, menghantarkan panas dan listrik, dapat ditempa menjadi lempengan tipis, serta dapat ditentangkan menjadi kawat/kabel panjang. Sifat-sifat logam tersebut diatas yang membedakan dengan unsur-unsur bukan logam. Sifat-sifat logam, dalam sistem periodik makin kebawah makin bertambah, dan makin ke kanan makin berkurang.
Batas unsur-unsur logam yang terletak di sebelah kiri dengan batas unsur-unsur bukan logam di sebelah kanan pada sistem periodik sering digambarkan dengan tangga diagonal bergaris tebal. Unsur-unsur yang berada pada batas antara logam dengan bukan logam menunjukkan sifat ganda.
Contoh :
- Berilium dan Aluminium adalah logam yang memiliki beberapa sifat bukan logam. Hal ini disebut unsur-unsur amfoter.
- Baron dan Silikon adalah unsur bukan logam yang memiliki beberapa sifat logam. Hal ini disebut unsur-unsur metalloid.
Kereaktifan
Reaktif artinya mudah bereaksi. Unsur-unsur logam pada sistem periodik, makin ke bawah makin reaktif, karena makin mudah melepaskan elektron. Unsur-unsur bukan logam pada sistem periodik, makin ke bawah makin kurang reaktif, karena makin sukar menangkap elektron.
Kereaktifan suatu unsur bergantung pada kecenderungannya melepas atau menarik elektron. Jadi, unsur logam yang paling reatif adalah golongan VIIA (halogen). Dari kiri ke kanan dalam satu periode, mula-mula kereaktifan menurun kemudian bertambah hingga golongan VIIA. Golongan VIIA tidak reaktif.





Tinggalkan Balasan